نظيرة دالتون (رذرفورد) الذرية
تنص على ان الذرة تتكون من اجزاء صغيرة جدا تسمى الذرات .الذرات لا تتجزأ ولا تفنى وتتشابه الذرات المكونة للعنصر في الحجم والكتلة والخواص الكيمياىية .تختلف ذرات اي عنصر عن ذرات العناصر الاخرى .الذرات المختلفة تتحد بنسبة عددية بسيطة لتكوين المركبات .وفي التفاعلات الكيمياىية :تنفصل الذرات اوتتحد اويعاد ترتيبها
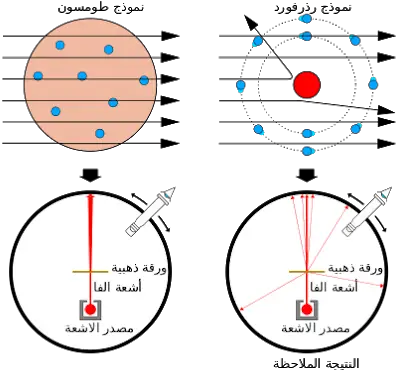
نظرية طومسون الذرية
افترض طومسون عام 1911 نموذجا نوويا للذرة وأساس هذا النموذج هو أن الذرة تتكون من جسيم صغير وثقيل ذو شحنة موجبة ويسمى النواة ويحتل مركز الذرة وتحتوي نواة الذرة على جميع البروتونات ولذا فان كتلة الذرة هي تعبير عن مجموع كتل البروتونات في نواتها (حيث أن قيمة كتل الاليكترونات صغيرة جدا اى قيم مهملة ) . كما أن شحنة النواة الموجبة ترجع إلى تمركز البروتونات الموجبة بها . وتتوزع اليكترونات الذرة حول النواة بنفس الطريقة التي تتوزع بها الأجرام السماوية حول الشمس . وبما أن الذرة متعادلة لذا فعدد الاليكترونات السيارة يساوي لعدد البروتونات بالنواة
وقد اثبتت نظرية دالتون خطأ نظرية طومسون .